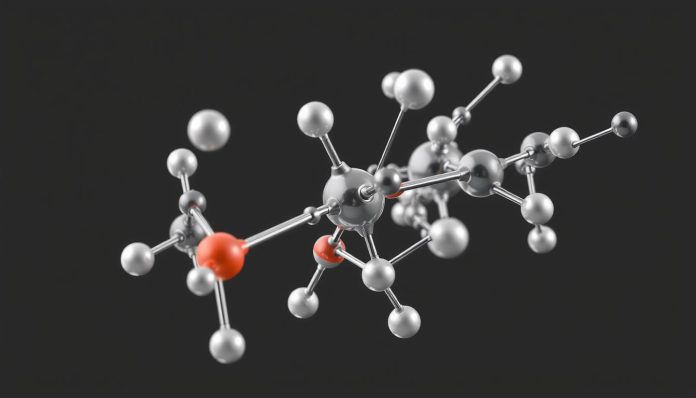
الروابط الكيميائية مهمة جدًا لفهم المواد. هذه القوى الخفية تربط الذرات لتشكيل المركبات الكيميائية. نرى هذه المركبات في الطبيعة والصناعة.
في عالم الكيمياء، الروابط الكيميائية تعتبر مفتاحًا. تساعد في فهم كيفية تفاعل العناصر. كل رابطة لها خصائص فريدة تؤثر على كيفية تكوين المركبات.
النقاط الرئيسية
- الروابط الكيميائية تربط الذرات لتشكيل مركبات كيميائية
- تختلف أنواع الروابط باختلاف العناصر المشاركة
- الجدول الدوري يساعد في فهم التركيب الكيميائي
- لكل رابطة كيميائية خصائص فريدة
- المركبات الكيميائية أساسية في الطبيعة والصناعة
مقدمة عن الروابط الكيميائية وأهميتها
الروابط الكيميائية هي أساس فهمنا للمادة. تشكل هذه الروابط القوة التي تجمع الذرات لتشكيل مركبات معقدة. إنها تنشأ من التجاذب الإلكتروني بين الذرات المختلفة.
تعريف الروابط الكيميائية
الروابط الكيميائية هي قوى تربط الذرات لتشكيل جزيئات ومركبات. توجد أنواع مختلفة منها:
- الرابطة التساهمية
- الرابطة الأيونية
- الرابطة التكافؤية
دور الروابط الكيميائية في تكوين المركبات
الروابط الكيميائية لها دور مهم في تحديد خصائص المواد. من خلال التجاذب الإلكتروني، تتفاعل الذرات وتشكل هياكل جزيئية معقدة.
أهمية فهم الروابط الكيميائية في العلوم الحديثة
فهم الروابط الكيميائية ضروري في مجالات عديدة مثل:
- علم المواد
- الكيمياء الحيوية
- الصناعات الدوائية
- تطوير التقنيات المتقدمة
بدراسة الرابطة التساهمية والرابطة الأيونية، يمكن للعلماء تصميم مواد جديدة. فهم التفاعلات المعقدة في الطبيعة يصبح ممكنًا.
روابط كيميائية: الرابطة الأيونية والتساهمية
الروابط الكيميائية مهمة جدًا لفهم المواد. في الكيمياء، هناك أنواع مختلفة من الروابط. هذه الروابط تربط الذرات بطرق فريدة.
- الرابطة الأيونية: تنشأ من انتقال الإلكترونات بين الذرات
- الرابطة التساهمية: تتشكل من مشاركة الإلكترونات بين الذرات
الرابطة الأيونية تنتقل الإلكترونات من ذرة لأخرى. هذا يخلق أيونات موجبة وسالبة. نظرية الروابط الفراغية تساعد في فهم ترتيب الإلكترونات.
الروابط التساهمية تعتمد على مشاركة الإلكترونات. تُفهم من خلال الميكانيكا الكوانتية. الإلكترونات تفاعل بطرق معقدة ودقيقة.
الرابطة الهيدروجينية نوع خاص من الروابط الضعيفة. تلعب دورًا كبيرًا في العمليات البيولوجية. مثل تركيب البروتينات والحمض النووي.
الرابطة الفلزية وتأثيرها على خصائص المعادن
الرابطة الفلزية تعتبر من أهم الروابط الكيميائية في المعادن. تساهم في إعطاء المعادن خصائصها المميزة. مثل التوصيل الكهربائي العالي والقدرة على التشكل.
آلية تكوين الرابطة الفلزية
تتشكل الرابطة الفلزية من مشاركة الإلكترونات بين ذرات المعدن. الإلكترونات الخارجية تتحرر لتكوّن “بحر الإلكترونات”. هذا البحر يحيط بالأيونات الموجبة للمعدن.
- تتميز الرابطة الفلزية بحركة الإلكترونات الحرة
- تساهم في التماسك بين ذرات المعدن
- تسمح بنقل الطاقة بسهولة
الخصائص الفيزيائية للمعادن بسبب الرابطة الفلزية
تؤثر الرابطة الفلزية بشكل مباشر على خصائص المعادن. مثل التوصيل الكهربائي والحراري العالي. الإلكترونات الحرة تحرك بسهولة، مما يجعل المعادن موصلات ممتازة للكهرباء والحرارة.
| الخاصية | التأثير |
|---|---|
| التوصيل الكهربائي | عالي بسبب حركة الإلكترونات |
| اللدونة | قابلية للطرق والسحب |
| التوصيل الحراري | نقل سريع للحرارة |
تطبيقات الرابطة الفلزية في الصناعة
تستخدم الرابطة الفلزية في صناعة الأسلاك الكهربائية. وكذلك في صناعة السبائك المتطورة. والمواد فائقة التوصيل التي تعتمد على خصائص هذه الروابط.
الخلاصة
الروابط الكيميائية مهمة لفهم كيفية عمل المواد. في هذا المقال، ناقشنا أنواع الروابط المختلفة. هذه الأنواع تشكل أساس التكوينات الذرية والجزيئية.
الأبحاث المستقبلية في هذا المجال ستفتح أبوابًا جديدة. ستساعد في تصميم أدوية جديدة وابتكار مواد جديدة في الصناعة والتكنولوجيا.
فهم الروابط الكيميائية يساعد في حل التحديات العلمية. هذا المجال يعتبر مفتاحًا للاكتشافات المستقبلية. لذا، من المهم الاستمرار في البحث والاستكشاف.